11月20日,中国海洋大学医药学院、海洋药物教育部重点实验室朱伟明教授团队与山东大学李盛英教授团队合作,在国际顶尖期刊Journal of the American Chemical Society发表题为《生物合成4-酰基-5-氨基咪唑生物碱的新颖傅-克氏酰化酶Biosynthesis of 4-Acyl-5-aminoimidazole Alkaloids Featuring a New Friedel–Crafts Acyltransferase》的最新研究进展(https://pubs.acs.org/doi/10.1021/jacs.3c09522)。

碳−碳键的形成是构建有机化合物骨架的关键步骤。傅-克氏酰基化(FCA)反应就是其中一类重要反应,可在芳香底物和酰基之间形成碳-碳键,生成结构多样的芳香酮类骨架,在医药工业上有广泛应用。开发绿色高效的FCA反应催化剂一直是领域研究热点,其中新型生物催化剂即傅-克氏酰基转移酶(FCase)的挖掘则是FCA反应绿色发展的重要途径。在探索海洋微生物天然产物的过程中,研究人员从一株来源于青岛近海深层土壤的链霉菌Streptomyces sp. OUCMDZ-944中分离获得了7个新的AAIAs类化合物,从中首次鉴定了该类生物碱的D-核糖苷AAIA-1-ribosides。基于结构信息的生源推测和13C同位素标记底物的饲喂实验,显示此类生物碱骨架是以初级代谢中嘌呤生物合成途径的中间体5-氨基咪唑核糖核苷酸(AIR)和醋酸-丙二酸途径合成的脂肪酸为结构模块,在系列酶的催化作用下由AIR的4-位芳香碳和脂肪酸的酰基碳的FCA反应生成。
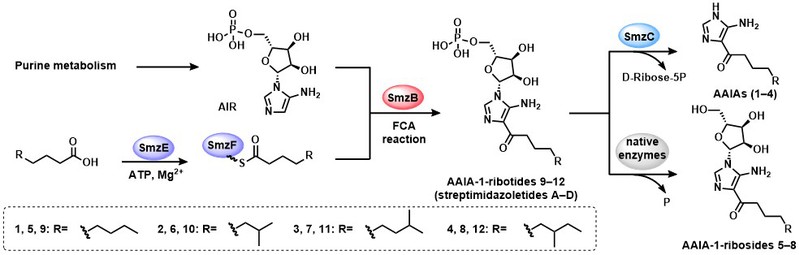
图1. AAIAs的生物合成途径
研究人员首先通过大片段的基因敲除与基因的异源表达实验鉴定了此株Streptomyces sp. OUCMDZ-944中的AAIAs生物合成基因簇(smz)。单基因缺失突变实验进一步明确了生物碱骨架合成的四个关键基因smzB, -C, -E和-F。结合关键基因的功能预测和突变菌株代谢谱的变化,逐渐揭开了新型FCase SmzB的神秘面纱。蛋白表达及体外酶反应实验进一步清晰地阐明了四个关键基因的功能,明确了AAIAs的生物合成途径。SmzE催化脂肪酸活化连接到酰基载体蛋白(ACP) holo-SmzF上后,由蛋白SmzB催化AIR和活化酰基之间发生FCA反应,再经由SmzC蛋白催化中间体的N-糖苷键断裂生成AAIAs类化合物,关键中间体的底物饲喂实验证明菌株的固有酶可催化脱磷酰化生成AAIA-1-ribosides,并证明了脂肪酸底物的宽泛性,5C~14C的脂肪酸均可被活化生成相应的酰基化产物。为了深入理解蛋白SmzB的催化机制,研究人员利用AlphaFold2构建了蛋白SmzB的3D结构模型,并预测了其催化口袋,分析了蛋白SmzB的保守残基。底物AIR与蛋白SmzB的docking分析及构象分析指导下的蛋白突变体的构建及催化活性研究,证明了氨基酸残基Tyr26、Cys49和Tyr93对蛋白SmzB催化功能的发挥至关重要。
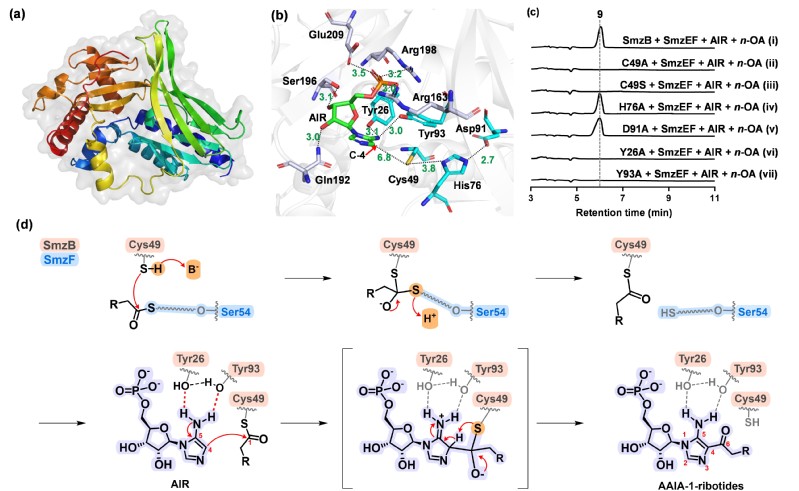
图2. 蛋白SmzB的催化机制分析
本文在发现7个新的4-酰基-5-氨基咪唑生物碱(AAIAs)类天然产物的基础上,首次解析了AAIAs的生物合成途径,并揭示了AAIAs类天然产物来自两个初级代谢(嘌呤代谢与脂肪酸代谢)之间的对话与互作,从中发现了一个独特而新颖的FCase-SmzB,突破了目前FCase的芳香底物的结构限制,为此类生物碱的结构拓展及生物合成与应用提供了重要思路。
夏雨微博士、朱国良博士和张兴旺博士为本文作者,朱伟明教授和山东大学李盛英教授团队的杜磊研究员为共同通讯作者,该工作得到国家重点研发计划项目和国家自然科学基金-山东省联合基金的资助。
