近日,中国海洋大学医药学院、海洋药物教育部重点实验室任为武教授课题组在单萜类吲哚生物碱的全合成方面取得新进展。相关研究成果以“Total synthesis of (+)-taberdicatine B and (+)-tabernabovine B((+)-Taberdicatine B和(+)-tabernabovine B的全合成)”为题,发表在Chin. Chem. Lett.(IF:9.1)期刊上。
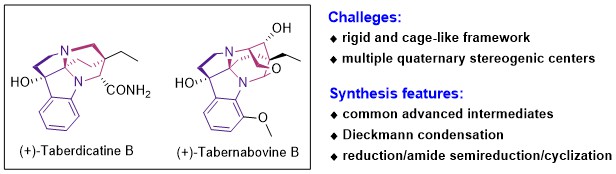
图1. Taberdicatine B和Tabernabovine B的结构和全合成关键步骤
夹竹桃科 (Apocynaceae) 狗牙花属植物 (Tabernaemontana Plants) 主要分布在南美洲和亚洲的热带和一些亚热带地区,该属包括大约120多个物种,含有丰富的吲哚类生物碱,是目前单萜类吲哚生物碱的主要来源。此类生物碱在传统医学中对治疗腹痛、高血压和咽喉痛等疾病有显著疗效。Tabernabovine B 和taberdicatine B是从该属植物中分离得到的新型单萜类吲哚生物碱,分子骨架都包含羟基取代的六氢吡咯并[2,3-b]吲哚 (C3a-OH-HPI) 骨架。其中,tabernabovine B分子主体为刚性六环体系,除上面部分的HPI环系外,下面还有一个含有氧桥的复杂的多环笼状体系。整体结构包含6个手性中心,其中有1个氧杂季碳,1个氮杂季碳和1个全碳季碳,并且有4个为连续手性中心。整个分子环系张力较大,结构高度紧凑,在合成上富有挑战性,这引起了作者对其进一步合成研究的兴趣。
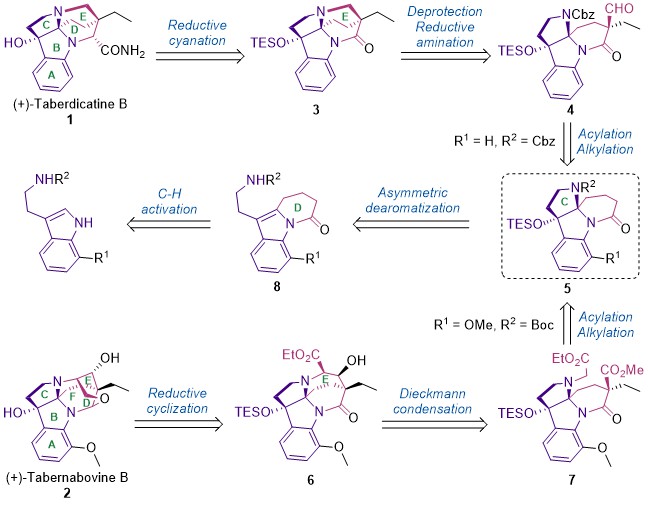
图2. 逆合成分析
任为武教授课题组从简单的原料出发,运用钯催化的交叉偶联反应构建δ-内酰胺以及不对称溴环化反应合成关键的手性C3a-OH-HPI环系,完成了两个分子共同中间体5的合成。然后从此中间体出发,通过内酰胺α位的酰基化和烷基化,高非对映选择性地得到中间体4和7。随后通过一步脱保护/还原胺化串联反应,以及Dieckmann酯缩合反应分别完成了两个天然产物关键的E环的构建,得到中间体3和6。最后通过酯还原/酰胺半还原/脱水环化串联反应等关键步骤,高效完成了 (+)-taberdicatine B和 (+)-tabernabovine B的首次不对称合成。这一工作为此类天然产物以及类化物和衍生物的制备提供了技术支持,有助于进一步的药物化学和分子生物学等研究。从该工作中得到的手性C3a-OH-HPI中间体出发,有望集群式合成更多此类型的天然产物。
本文的第一完成单位是中国海洋大学医药学院。任为武教授为通讯作者。文章的第一作者是中国海洋大学医药学院博士研究生宣腾飞。该工作得到了国家自然科学基金、青岛海洋科技中心科技创新项目、中国海洋大学青年科技人才培育基金、泰山学者青年专家项目的支持。
文章链接:https://doi.org/10.1016/j.cclet.2024.109816
https://www.sciencedirect.com/science/article/pii/S1001841724003358
