| 张海峰 | 博士 | 青年英才第二层次 | 博士生导师 | |
科 室: | 分子医学生物学 | ||||
办公电话: | 18853396899 | 电子邮箱: | zhang_haifeng@ouc.edu.cn | ||
联系地址: | 山东省青岛市鱼山路5号中国海洋大学医药学院266003 | ||||
研究方向: | 1. 肌肉发育与再生的分子机制 2. 肌肉疾病相关新功能基因的发现与信号通路研究 3. 肌肉衰老相关模型构建及药物筛选研究 | ||||
个人简介 |
|
|
|
| |
张海峰,博士,山东省泰山学者青年专家,自2025年2月起加入中国海洋大学医药学院开展独立研究工作。主要从事骨骼肌发育与再生的分子机制与进化研究,解析其中关键的信号通路及调控机制。近年来对本研究领域的贡献主要包括:(1)系统性阐述了参与人类骨骼肌发育的调控因子(2)阐明了CHAMP1调控肌肉细胞融合的分子机制,为CHAMP1疾病的治疗提供了理论依据(3)原创性阐明肌肉细胞多核化性状在进化上的起源及其与新基因功能出现之间的紧密联系(2)提出一个人类肌肉细胞融合的新分子模型。近年来,以第一作者先后在Nature Communications(2025a, 2025b)、Science Advances(2022, 2020)、Plos Genetics以及Journal of Biological Chemistry等高水平SCI期刊发表多篇研究论文。 | |||||
教育背景 |
|
|
|
| |
2014年9月至2018年7月 | 中国海洋大学 海洋生命学院 | 遗传学 | 博士 | ||
2011年9月至2014年7月 | 中国海洋大学 医药学院 | 生药学 | 硕士 | ||
2007年9月至2011年7月 | 青岛农业大学 生命科学学院 | 生物技术 | 学士 | ||
工作经历 |
|
|
|
| |
2025年2月至今 | 中国海洋大学 医药学院 | 英才二 |
| ||
2018年10月至2025年1月 | 佐治亚大学 分子医学中心 | 博士后 |
| ||
|
|
|
| ||
研究进展 |
|
|
|
| |
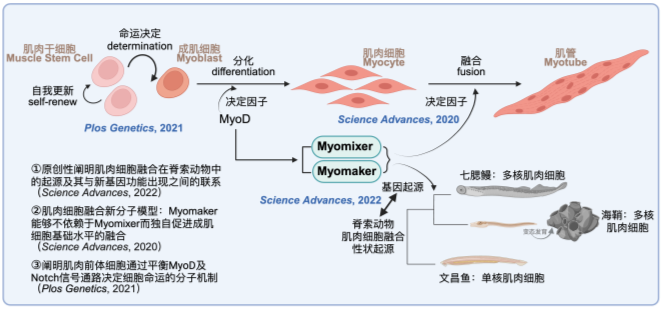
骨骼肌作为人体最大的组织,肌纤维多核化是其最主要的特征之一。多核化使得数百甚至成千上万个单核肌肉细胞的功能协调成为一个肌纤维单元,多核肌纤维的形成是肌肉细胞融合的结果。此前的研究鉴定了目前仅有的两个在肌肉细胞融合阶段特异性表达且对细胞融合的发生充分且必要的融合素(Fusogen)因子:Myomixer(Bi. et al., Science, 2017)和Myomaker(Millay. et al., Nature,2013)。近年来,我们围绕人类肌肉发育的分子机制及Myomixer和Myomaker两个基因在进化上的起源等科学问题开展了系列研究,主要取得以下研究成果:1, 原创性的阐明了脊索动物肌肉细胞融合表型的出现与新基因功能出现的紧密关联:Myomaker最早在脊索动物门的被囊动物中以基因复制的形式出现并导致被囊动物成肌细胞融合表型的出现,随后Myomixer在无颌类脊椎动物中以新生基因的形式出现与Myomaker协同作用从而显著提高细胞融合的效率。2, 提出一个人类肌肉细胞融合的新分子模型:Myomaker独立促进成肌细胞基础水平融合,Myomixer与Myomaker协同促进更高水平的细胞融合。3, 通过CRISPR/Cas9介导的全基因组水平的高通量筛选,鉴定了多个新的参与肌肉细胞分化及融合的调控因子。
| |||||
代表性成果 | |||||
代表性论文(*co-first author): | |||||
1. Haifeng Zhang, Min Zhou, Zheng Zhang, Zhaoning Wang, Ruifeng Shi, Yushu Wang, Xiaolin Wei, Renjie Shang, Jianwen Li, Cuiyu He, Jin Xie, Yarui Diao, Pengpeng Bi. CHAMP1 is an essential regulator for human myoblast fusion and muscle development. Nature Communications. 2025. 2. Haifeng Zhang*, Renjie Shang*, Zheng Zhang*, Min Zhou, Anne Bigot, Yanqing Cai, Yanran Zhao, Yushu Wang, Aaryahi Deshmukh, Elena Kudryashova, Dmitri S.Kudryashov, Cuiyu He,Vincent Mouly, Pengpeng Bi. Development of a split-toxin CRISPR screening platform to systematically identify regulators of human myoblast fusion. Nature Communications. 2025. 3. Haifeng Zhang, Renjie Shang, Kwantae Kim, Wei Zheng, Christopher J. Johnson, Lei Sun, Xiang Niu, Liang Liu, Jingqi Zhou, Lingshu Liu, Zheng Zhang, Theodore A. Uyeno, Jimin Pei, Skye D. Fissette, Stephen A. Green, Sukhada P. Samudra, Junfei Wen, Jianli Zhang, Jonathan T. Eggenschwiler, Douglas B. Menke, Marianne E. Bronner, Nick V. Grishin, Weiming Li, Kaixiong Ye, Yang Zhang, Alberto Stolfi, Pengpeng Bi. Evolution of a chordate-specific mechanism for myoblast fusion. Science Advances. 2022; 8: eadd2696. 4. Haifeng Zhang, Junfei Wen, Anne Bigot, Jiacheng Chen, Renjie Shang, Vincent Mouly, Pengpeng Bi. Human myotube formation is determined by MyoD–Myomixer/Myomaker axis. Science Advances. 2020; 6: eabc4062. 5. Haifeng Zhang, Renjie Shang, Pengpeng Bi. Feedback regulations of Notch signaling and myogenesis connected by MyoD–Dll1 axis. Plos Genetics. 2021; 17: e1009729. 6. Haifeng Zhang*,Xiaozhi Rong*, Caixia Wang, Yunzhang Liu, Ling Lu, Yun Li, Chengtian Zhao, Jianfeng Zhou. VBP1 modulates Wnt/β-catenin signaling by mediating the stability of the transcription factors TCF/LEFs. Journal of Biological Chemistry. 2020; 295, 16826-16839. 7. Renjie Shang, Haifeng Zhang, Pengpeng Bi. Generation of mouse conditional knockout alleles in one step using the i-GONAD method, Genome Research, 2021, 31: 121-130
| |||||
项目课题 | |||||
1. 中国海洋大学“青年英才工程“启动基金,2025-2029,在研,主持 2. 山东省泰山学者青年专家项目,2025-01-01至2027-12-31,在研,主持;
| |||||