近日,中国海洋大学医药学院李德海教授团队在国际顶级期刊Chemical Science发表题为《Multifunctional Cytochrome P450 Orchestrates Radical Cleavage and Non-radical Cyclization in 5-Oxaindolizidine Biosynthesis》的最新研究进展(doi.org/10.1039/D4SC07174C)。该研究通过基因组挖掘、生物合成基因簇的异源表达、底物饲喂、中间体及结构类似物合成,关键活性中间体还原性捕获以及点突变等实验阐明了具有5-氧杂吲哚里西啶核心化合物penicilactam A(1)的生物合成过程,并发现了一个新的多功能P450酶PnltC,其通过双模式催化机制实现分子骨架重构,完成从scalusamide A(2)到1的5-氧杂吲哚里西啶核心骨架构建。
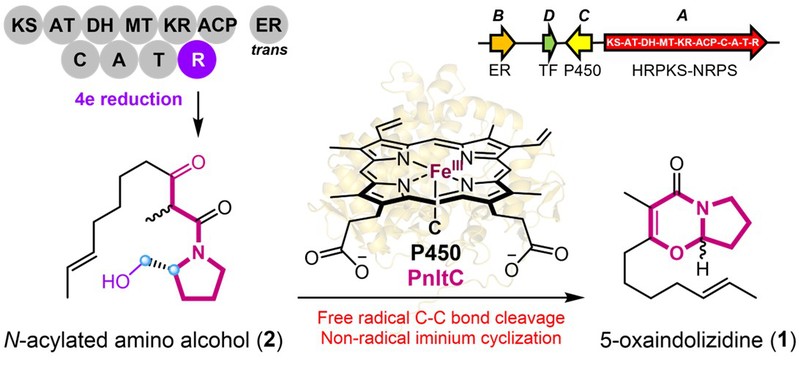
真菌5-氧杂吲哚里西啶生物碱是一类独特的杂环天然产物,根据其核心结构特征,该家族化合物可主要分为两个主要亚型(图1)。Penicilactam A(1),首次报道分离自Penicillium brevicompactum,是一种由真菌产生的生物碱类化合物,具有独特的5-氧杂吲哚里西啶核心结构,并具有潜在的杀虫活性。然而,该化合物的化学合成产率低、步骤繁琐,制约了该分子的深入开发与应用。为解决这一问题,研究人员从橘青霉(Penicillium citrinum)HDN11-186基因组中挖掘负责化合物1生物合成的基因簇pnlt。该基因簇中,杂合型聚酮合酶-非核糖体肽合成酶(PKS-NRPS)首先组装出N-酰基-D-脯氨酸中间体scalusamide A(2)。随后,单一细胞色素P450酶PnltC直接催化其转化为具有5-氧杂吲哚里西啶核心的Penicilactam A(1)(图1)。
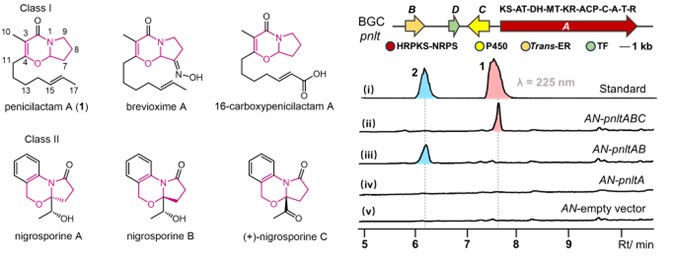
图1:已报道分离的5-氧杂吲哚里西啶类天然产物与基因簇pnlt的异源表达
通过对化学合成的中间体及结构类似物进行底物饲喂、STAB还原捕获亚胺阳离子实验,证实了1中5-氧杂吲哚里西啶核心骨架的生成依赖于P450氧化酶PnltC催化的连续氧化脱羧,且在反应过程中存在亚胺阳离子中间体。随后,基于推测路径的DFT计算以及点突变实验,进一步推测了P450酶PnltC的催化机制(图2)。其可以催化自由基参与的C−C键断裂,同时利用亚胺阳离子存在时的非自由基亲核环化实现最终骨架的构建。
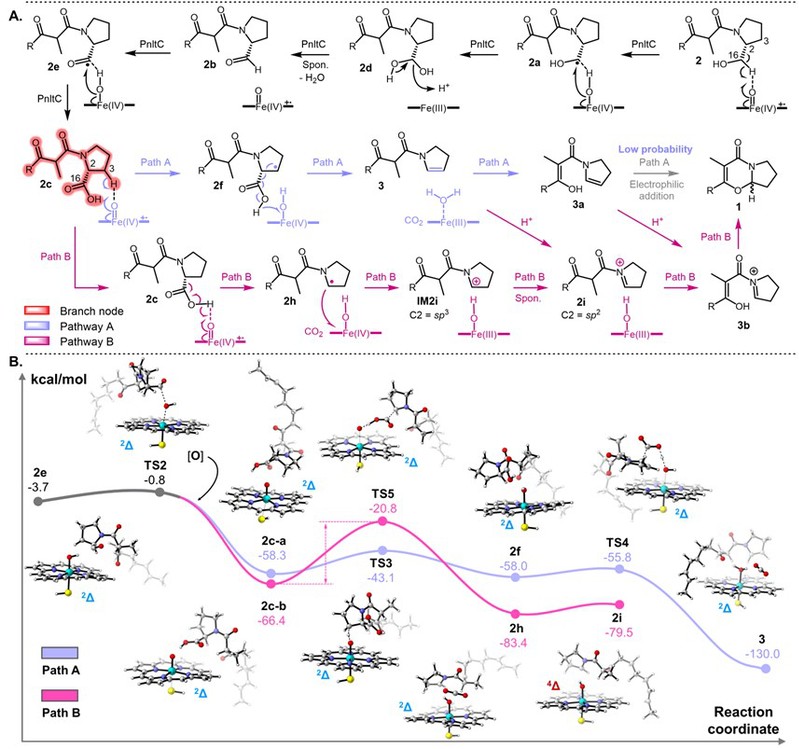
图2:推测的两种PnltC催化机制以及进一步的DFT计算
此外,同源基因簇的表达研究揭示该类基因簇的强保守性。最后,通过粗酶实验确定化合物了2中D构型脯氨醇残基的来源,实现了对化合物1生物合成途径的完整解析(图3)。有意思的是,该类结构生成过程中涉及多个活性中间体,可以导致不同的分流产物产生。同时,中间体在不同溶剂中也存在广泛的自发反应,因此,对反应过程和产物的准确检测在研究中至关重要。

图3:Penicilactam A(1)可能的生物合成路径
综上所述,该研究证明了P450酶PnltC能够串联催化自由基氧化与非自由基环化反应,首先经自由基介导的C−C键断裂生成烯胺中间体,继而通过非自由基途径形成亚胺阳离子中间体,最终驱动分子内亲核加成反应生成化合物1,这在P450酶中较为罕见。该研究为可持续获取1提供了绿色生物合成方法,并拓展了对P450酶催化生成新型天然产物机制的理解。
中国海洋大学为唯一通讯单位,李德海教授为通讯作者,医药学院博士研究生张开金、硕士研究生孙静贤为并列第一作者。宋文才、刘峻妤、马传腾、陈颖涵、关燕、刘雨婷、任姿霖以及车茜副教授、张国建教授、刘延凯教授、朱天骄教授为文章共同作者。该工作得到国家自然科学基金、青岛海洋科技中心科技创新项目、山东省泰山学者青年专家项目、山东省自然科学基金重大基础研究项目和中央高校基本科研业务费资助。
文章链接:doi.org/10.1039/D4SC07174C
